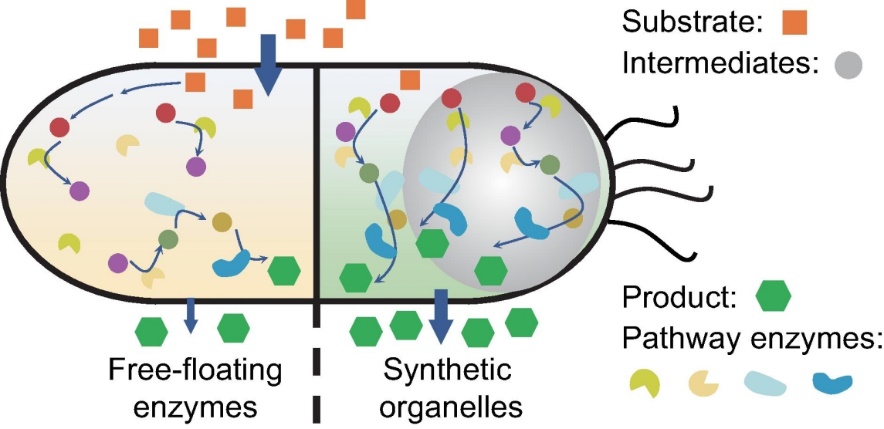
作为一种有效的翻译后调控策略,将多种途径酶空间组织到构建的人工支架中以增强靶通路代谢通量受到越来越多的关注。这种多酶聚类方法可以促进代谢通道的形成,从而带来几个明显的优势,如防止有毒中间体的积累,减轻中间体的扩散,通过增加酶和底物的局部浓度来提高转化效率等等。除了将多种酶组装成超分子复合物外,最近,通过活细胞中的液-液相分离(LLPS)过程形成功能性无膜细胞器(MLOs)的策略为酶组装提供了一个很好的思路。MLOs是液体样结构,可以通过过表达由大段低复杂度氨基酸序列组成的固有无序蛋白(IDPs)和/或特定核酸序列来构建。
近期,我室沐万孟教授报导了基于内在无序蛋白域的相分离合成细胞器,用于大肠杆菌的代谢途径组装。该研究成果以“Phase-Separated Synthetic Organelles Based on Intrinsically Disordered Protein Domain for Metabolic Pathway Assembly inEscherichia coli”为题,发表于ACS Nano (IF = 18.027)(https://doi.org/10.1021/acsnano.3c02333)。
首先,作者通过无序度算法预测秀丽隐杆线虫来源的LAF-1蛋白中的RGG域是高度无序的,且RGG域已被报导可以在体内外发生相分离并聚集,生成蛋白冷凝物。RGG无序蛋白主要通过静电相互作用,阳离子-π相互作用,氢键等非共价作用力实现自发聚集。在大肠杆菌中过表达融合绿色荧光蛋白的RGG-sfGFP,通过共聚焦成像可以清晰的看到,目标蛋白聚集在大肠杆菌两极。通过荧光漂白恢复(FRAP)实验发现形成的聚集物具有一定的流动性。因此,通过异源表达RGG域实现了在大肠杆菌中构建人工无膜细胞器。
接着作者从蛋白胞内表达水平,诱导表达温度,RGG价态,RGG蛋白的可溶性表达等方面对该内在无序蛋白在大肠杆菌中的表达进行表征。共聚焦及荧光分布情况分析结果显示,RGG-sfGFP在各种表达条件下都能在一定程度上发生蛋白聚集,且聚集物大都分布在细胞两极;串联融合表达两个RGG结构域,也即二价的RGG蛋白相较于单个RGG蛋白更容易发生相分离,但该蛋白在胞内形成不可溶的包涵体,因此,后续依然以单个RGG域作为无膜细胞器的骨架蛋白。
验证了基于RGG的无膜细胞器对客户蛋白的富集能力,作者直接将两种荧光蛋白融合RGG蛋白,并在胞内共表达,发现两种荧光信号都共定位到大肠杆菌细胞两极。考虑到后续实验中直接将含一百多个氨基酸的RGG域融合到目标酶上很可能对酶的功能产生影响,作者进一步引入高亲和力的蛋白互作标签(RIAD-RIDD),将短肽标签分别融合到RGG蛋白和客户蛋白上。共聚焦成像结果显示,融合了互作标签RIAD的荧光蛋白都高效的被募集到胞内无膜细胞器中,而不添加互作标签的蛋白则无法被募集,因而均匀的弥散在胞质中。因此,通过RGG结构域和蛋白互作标签,成功实现将多个客户蛋白募集到人工无膜细胞器中。
以从头合成2′-岩藻糖基乳糖(2′-FL)代谢通路为验证对象,将代谢通路中的多个酶融合上述蛋白互作标签,从而将通路酶募集到无膜细胞器中,形成代谢底物通道,实现中间产物的快速转化,以强化代谢通量。实验结果显示,融合了四个通路级联酶的实验菌株,其2′-FL产量是对照菌株的2.4倍,底物转化率提高了95%。通过诱导表达和培养条件的优化,进一步扩大2′-FL的生产效率。
因此,本文构建的基于RGG无序蛋白的人工合成无膜细胞器系统为微生物细胞工厂的发展提供了一种有效的策略,可用于代谢途径酶的区室化以强化目标化学品的产量和生产效率。
沐万孟教授为论文的通讯作者,江南大学食品学院2021级博士生万李为第一作者。上述研究得到了国家重点研发计划(No. 2022YFC2104900)和中央高校基本科研基金(JUSRP622008)的资助。